KOREA PHARMACEUTICAL TRADERS ASSOCIATION
개요
임상시험용의약품을 수입하고자 하는 자는 식품의약품안전처장의 임상시험계획승인을 받아야 하며, 매 수입 시마다 한국의약품 수출입협회장에게 전자무역문서로 표준통관예정보고를 신청하여 요건확인을 받고 수입∙통관하여야 합니다.
임상시험용의약품이란?
임상시험* 에 사용되는 시험약 및 대조약을 말합니다. ‘시험약’이란 임상시험용 의약품 중 대조약을 제외한 의약품을 말하며, 대조약이란 시험약과 비교할 목적으로 사용하는 위약 또는 개발 중이거나 시판중이거나 시판 중인 의약품을 말합니다. (의약품 임상시험 관리기준)
* 임상시험용의약품의 안전성과 유효성을 증명할 목적으로, 해당 약물의 약동(藥動)·약력(藥力)·약리(藥理)·임상(臨床) 효과를 확인하고 이상반응을 조사하기 위하여 사람을 대상으로 실시하는 시험 또는 연구를 말한다. 이 경우 임상시험의 단계는 임상시험용의약품을 최초로 사람에게 투여하는 제1상(임상약리시험 등), 환자군에서 치료적 유효성을 탐색하여 가능한 용량과 투여기간 설정을 위한 다양한 정보 수집을 목적으로 하는 제2상(치료적 탐색 임상시험 등), 의약품의 안전성과 유효성을 확증하기 위한 제3상(치료적 확증 임상시험 등), 품목허가 후 허가사항의 범위에서 수행하는 제4상으로 구분한다.
관련규정
임상시험용의약품 수입절차
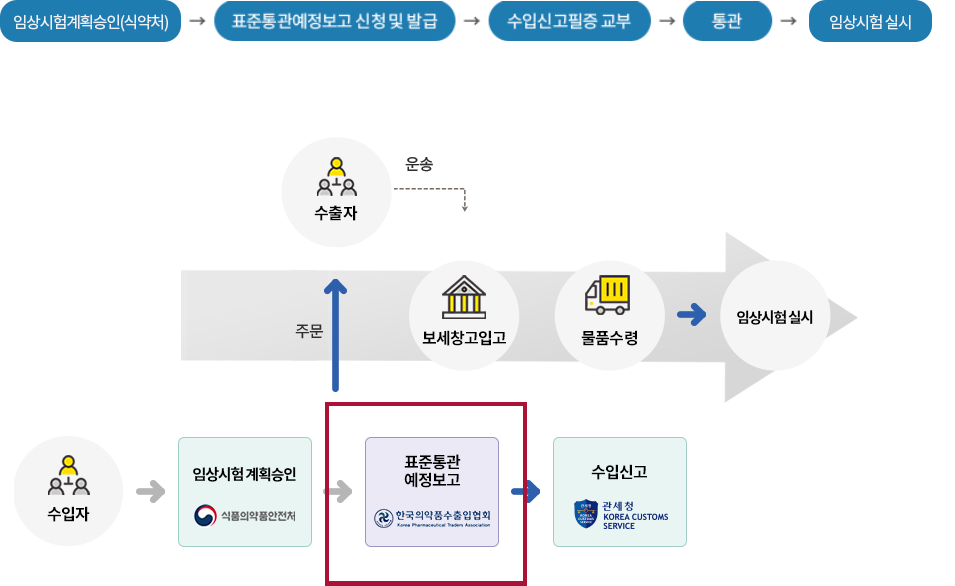
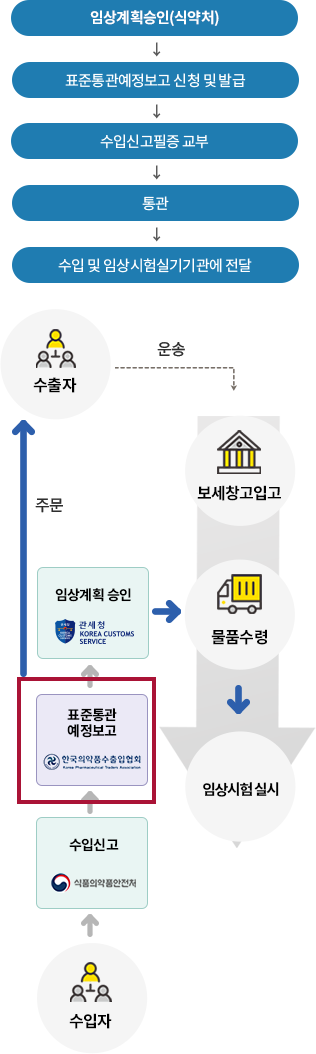
수입자 자격요건
임상시험계획승인을 받은 자
* 임상시험계획승인을 받은 자의 의뢰를 받아 타사(CRO 등)가 수입하는 경우, 임상시험계획승인을 받은 자와 타사의 수입업무위수탁체결서를 제출표준통관예정보고서 신청방법
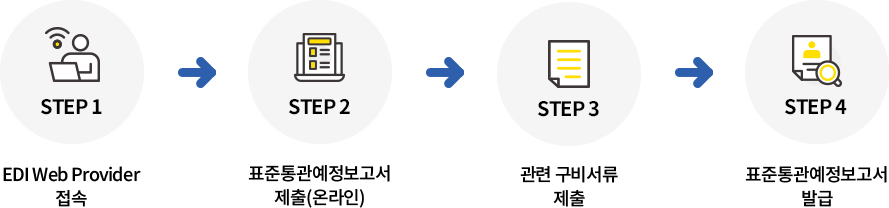

구비서류
문의
| 구분 | 담당자 | 연락처 |
|---|---|---|
| 임상시험용의약품 | 김보라 책임매니저 | 02-2162-8042 |
| 오다인 매니저 | 02-2162-8032 | |
| 임상시험용의약품의 원료 | ||
| 김보라 매니저 | 02-2162-8042 |