KOREA PHARMACEUTICAL TRADERS ASSOCIATION
개요
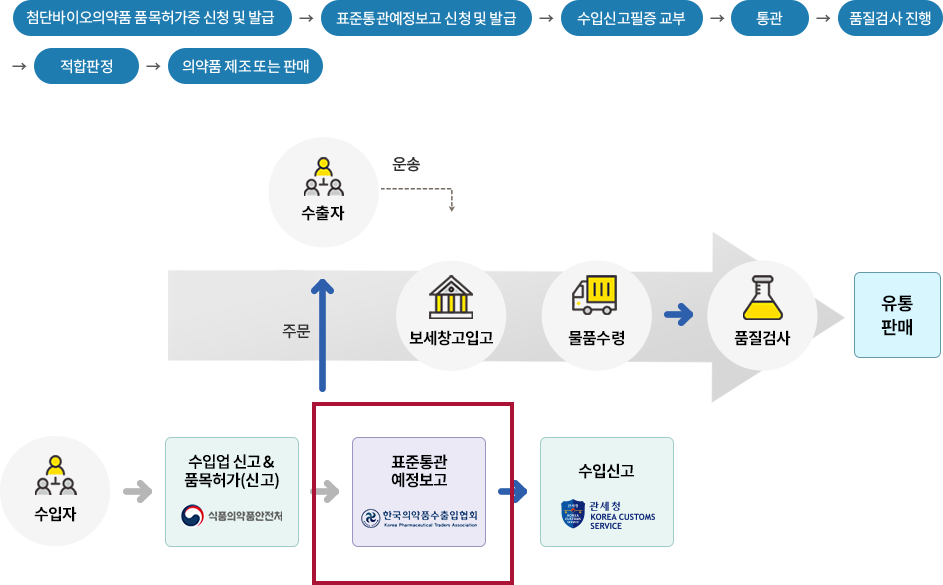
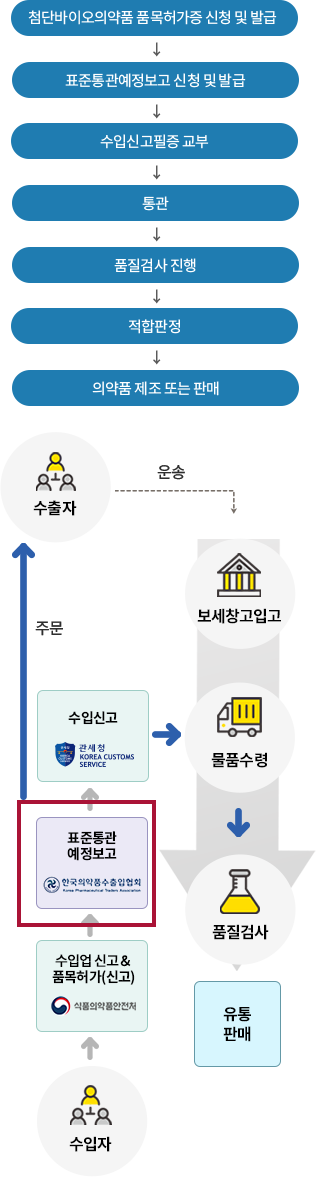
첨단바이오의약품을 수입하고자 하는 자는 「첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률」 제27조의 규정에 의하여 수입업신고 및 품목마다 식품의약품안전처장으로부터 허가를 받고, 매 수입시마다 식품의약품안전처장이 정한 「수입 의약품등 관리규정」에 의하여 한국의약품수출입협회장에게 전자문서교환방식에 의한 표준통관예정보고서를 필한 후 수입·통관하여야 합니다.
첨단바이오의약품이란?
「약사법」 제2조제4호에 따른 의약품으로서 다음 각 목의 어느 하나에 해당하는 것
가
세포치료제: 사람 또는 동물의 살아 있는 세포를 체외에서 배양·증식하거나 선별하는 등 물리적, 화학적 또는 생물학적 방법으로 조작하여 제조한 의약품. 다만, 생물학적 특성이 유지되는 범위에서 단순분리, 세척, 냉동, 해동 등의 최소한의 조작을 통하여 제조된 것으로서 총리령으로 정하는 것은 제외나
유전자치료제: 유전물질의 발현에 영향을 주기 위하여 투여하는 것으로서 유전물질을 함유한 의약품 또는 유전물질이 변형·도입된 세포를 함유한 의약품다
조직공학제제: 조직의 재생, 복원 또는 대체 등을 목적으로 사람 또는 동물의 살아 있는 세포나 조직에 공학기술을 적용하여 제조한 의약품라
첨단바이오융복합제제: 세포치료제, 유전자치료제, 조직공학제제와 「의료기기법」 제2조제1항에 따른 의료기기가 물리적·화학적으로 결합(융합, 복합, 조합 등을 포함한다)하여 이루어진 의약품. 다만, 주된 기능이 의료기기에 해당하는 경우는 제외마
그 밖에 세포나 조직 또는 유전물질 등을 함유하는 의약품으로서 총리령으로 정하는 의약품관련규정
첨단바이오의약품 수입절차
수입자 자격요건
수입자 시설기준
첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률 시행령 제27조(첨단바이오의약품 수입업의 시설 기준)
영업소 및 창고의 조건 (의약품 등의 제조업 및 수입자의 시설기준령 시행규칙 제9조제1항)
1
쥐∙해충 등을 막을 수 있는 시설2
저온 보관 및 빛가림을 위한 시설3
생물학적 제제의 보관시설4
마약 및 향정신성의약품의 보관시설5
보관방법이 정하여진 의약품등의 경우에는 그 보관조건을 유지할 수 있는 시설시험실(품질검사) (의약품 등의 제조업 및 수입자의 시설기준령 시행규칙 제11조 관련)
수입자는 시험실과 시험에 필요한 시설 및 기구를 갖추고, 제조번호 별로 품질검사를 하여야 합니다. 다만 식약처장이 지정한 의약품 품질검사를 대행하는 검사기관의 시설 및 기구를 이용하여 시험검사를 하는 경우에는 별도로 품질검사기관을 두지 아니할 수 있습니다. ※ 참고: 위탁품질검사기관 한국의약품시험연구원(TEL: 02-2162-8100)
수입업신고
첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률 시행령 제27조(첨단바이오의약품 수입업의 시설 기준)
경과조치
제2조(허가ㆍ신고 등에 관한 경과조치)
1
이 법 시행 당시 「약사법」에 따라 의약품 제조업허가를 받거나 수입업신고 또는 위탁제조판매업신고를 한 자로서 첨단바이오의약품을 제조(위탁제조를 포함한다)하거나 수입하는 자는 제23조제1항ㆍ제3항 또는 제27조제1항에 따라 허가를 받거나 신고를 한 것으로 본다. 다만, 이 법 시행 후 1년 이내에 식품 의약품안전처장에게 다시 허가를 받거나 신고를 하여야 한다.2
이 법 시행 당시 「약사법」에 따라 첨단바이오의약품에 대하여 품목허가 또는 수입품목허가를 받은 자는 제23조제2항ㆍ제3항 또는 제27조제1항에 따라 품목허가를 받은 것으로 본다. 다만, 이 법 시행 후 1년 이내에 식품의약품안전처장에게 다시 허가를 받아야 한다.첨단바이오의약품 허가·신고 방법
표준통관예정보고서 신청방법
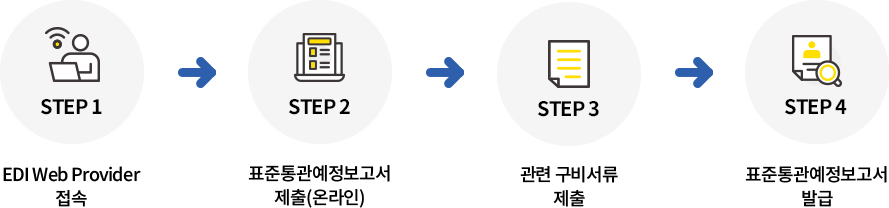

구비서류
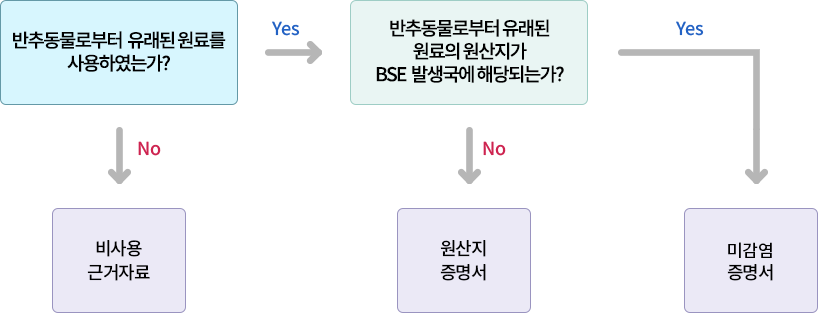
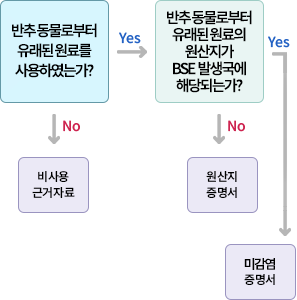
BSE(Bovine Spongiform Encephalopathy) 적용 기준은?
문의
| 구분 | 담당자 | 연락처 |
|---|---|---|
| 첨단바이오의약품 | 정다운 책임매니저 | 02-2162-8041 |